Tests In Vitro
Nos tests in vitro ADME et DMPK portent sur la solubilité, le métabolisme in vitro, la perméabilité in vitro et les transporteurs, la liaison aux protéines et la bioanalyse.
Nos services ADME sont conformes aux différentes guidelines (BPL, FDA, EMA, OCDE) et peuvent également être menés en mode screening.
Eurosafe intervient pour de nombreux acteurs comme les big pharma, les industries chimique, biotechnologique et agrochimique.
Identification et établissement de profil des métabolites par spectrométrie de masse à haute résolution et éventuellement quantification.
Le métabolisme d'un composé contribue souvent à son efficacité et à sa toxicité observée in vivo.
Nous proposons plusieurs tests standardisés :
- Identification de métabolite,
- Établissement de profil des métabolites,
- Stabilité des métabolites,
- Identification des enzymes métabolisantes,
- Stabilité dans le plasma et le tampon (partie de l'évaluation du BCS),
- Modélisation PBPK
Les études de métabolisme in vitro menées dans des matrices biologiques allant de cellules isolées à des fractions subcellulaires, permettent d’évaluer le potentiel métabolique intrinsèque ou des mécanismes spécifiques par rapport à une réaction donnée.
Eurosafe recommande l'incubation des microsomes de foie, d’intestin et de peau, ainsi que des hépatocytes, HepaRG ™, des enzymes exprimées et du plasma.
De plus, des systèmes in vitro dérivés de différentes espèces animales permettent de comparer les voies métaboliques entre espèces (y compris l'homme) avant qu'un composé donné puisse être testé cliniquement. Les métabolites des enzymes de phase I et de phase II sont analysés.
Pour vérifier si un médicament expérimental est victime d’interactions médicamenteuse, les sponsors doivent utiliser les auteurs d’index. Ceux-ci inhibent ou induisent le métabolisme ou le transport d'un médicament par une voie donnée et sont couramment utilisés dans les études prospectives d’interactions médicamenteuse.
Notre objectif:
S'assurer qu'aucun candidat au développement n'échoue en in vivo en raison d'une propriété métabolique ou pharmacocinétique imprévue.
Nos services :
- Induction
- Inhibition
- Phénotypage
Détails
Évaluation des interactions médicamenteuses entre transporteurs
Les transporteurs membranaires ont des effets cliniquement pertinent sur la pharmacocinétique et la pharmacodynamique des médicaments dans divers organes et tissus en contrôlant l'absorption, la distribution et l'élimination des médicaments (Giacomini, Huang, et al. 2010; Giacomini and Huang 2013).
Plusieurs transporteurs interagissent avec des médicaments cliniquement pertinents. Lien vers les guidelines FDA.
Par exemple:
- P-glycoprotéine (protéine P-gp ou Multi-drug Resistance 1 (MDR1)),
- Protéine de résistance au cancer du sein (PRCB),
- Le polypeptide de transport d'anion organique 1B1 / 1B3 (OATP1B1 / OATP1B3),
- Transporteur d'anions organiques 1/3 (OAT1 / OAT3),
- Protéines d’extrusion de médicaments multiples et de toxines (MATE),
- Transporteur de cations organiques 2 (OCT2).
Comprendre si un médicament donné se comporte comme un substrat (c.-à-d. inhibiteur ou inducteur) de ces transporteurs essentiels aidera à expliquer les conséquences cliniques (c.-à-d. La toxicité ou une efficacité altérée) résultant de la distribution tissulaire altérée d'un médicament déterminé servant de substrat à une membrane transporteur.
Couplés à des méthodes d'extrapolation appropriées in vitro et in vivo telles que le PBPK, ces tests permettent de déterminer si le sponsor doit mener des études d'interaction médicamenteuse in vivo.
Actuellement, les méthodes in vitro d'évaluation de l'induction des transporteurs ne sont pas bien comprises.
Identifier la fraction libre d'un médicament sur les protéines plasmatiques, les cellules ou les fractions sub-cellulaires.
Eurosafe propose différentes approches pour évaluer la liaison aux protéines plasmatiques :
- La méthode de la dialyse à l'équilibre. C'est la plus largement utilisée, considérée comme le “gold standard” pour l'évaluation de la liaison des médicaments. En effet, la fixation non spécifique est réduite au minimum.
- La méthode de partage entre érythrocytes et protéines plasmatiques, lorsque la molécule est lipophile ou que la fixation non spécifique est élevée.
Etudier la liaison d'un médicament sur les différentes proteines plasmatiques et les érythrocytes permet aussi d'évaluer sa distribution sanguine. A partir de cette distribution, connaissant les capacités de liaison (NKa), on peut simuler les conditions physio-pathologiques humaines.
Eurosafe réalise des études ex-vivo permettant d’établir une corrélation entre le pourcentage de liaison plasmatique d’un candidat médicament (ayant une forte affinité pour les HDL) sur 50 échantillons plasmatiques provenant d’une étude pharmacocinétique et présentant de fortes variations de la concentration de cette lipoproteine (p<0.0001).
Eurosafe réalise aussi l'évaluation de la liaison aux protéines microsomales et aux cellules pour évaluer la fraction libre (fumic, fuhep) et prédire précisément la clairance hépatique ou le potentiel d'interaction médicamenteuse in vivo par des données métaboliques microsomales in vitro.
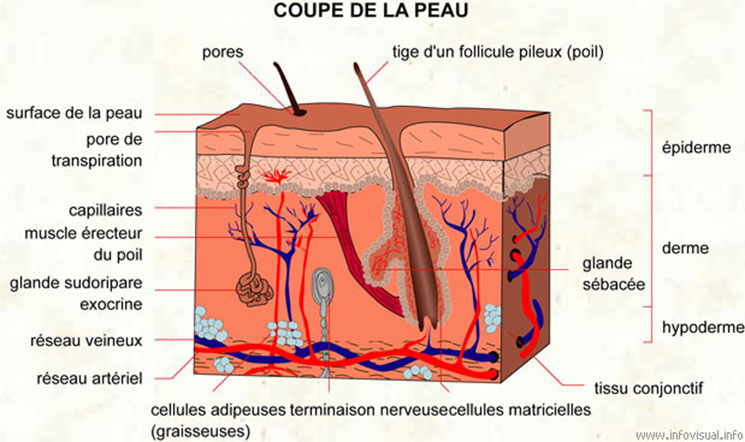
Evaluation du passage transcutané et de la délivrance d'une substance d'essai en utilisant une peau excisée
Afin d’évaluer la possibilité d’effets périphériques lors de l’administration cutanée de composés à tester, il est essentiel d’évaluer le potentiel de passage transcutané de ces composés.
Les méthodes in vitro mesurent la diffusion de produits chimiques à travers la peau dans un réservoir de fluide. La peau cryoconservée sert uniquement à mesurer la diffusion, tandis que la peau fraîche métaboliquement active sert à mesurer simultanément la diffusion et le métabolisme cutané.
De tels procédés sont utilisés pour des tests screening qui permettent de comparer la libération transcutanée de produits chimiques provenant de différentes formulations. Ces méthodes fournissent également des modèles utiles pour l'évaluation de l'absorption percutanée chez l'homme. Des données acceptables provenant d'au moins quatre réplicats par préparation de test sont nécessaires.
Dans des conditions appropriées, décrites dans les lignes directrices de l'OCDE 428, l'absorption des composés à tester pendant un intervalle de temps donné est mesurée en analysant à la fois le fluide récepteur et la peau traitée.
Le composé d’essai restant à la surface de la peau doit être considéré comme absorbé, à moins que l’on puisse démontrer de manière concluante que l’absorption peut être déterminée à partir des valeurs du fluide récepteur seul.
L’analyse d’autres composants (par exemple, le produit restant dans les couches de peau) permet une évaluation plus poussée des données, y compris la disposition totale de la substance d’essai et le pourcentage de récupération.
Tous les composants de la peau doivent être analysés et la récupération doit également être déterminée. Cela inclut le rinçage de la surface de la peau et du liquide récepteur.
Dans certains cas, la peau peut être fractionnée en stratum corneum, épiderme et derme pour une analyse supplémentaire.
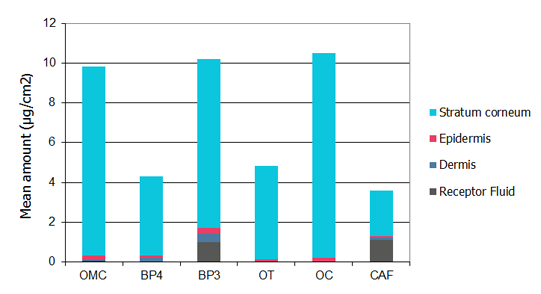
Effet de la formulation sur l'absorption transcutanée d'un composé à tester
Permeability assay for predicting the in vivo absorption of drugs across the gut wall by measuring the rate of transport of a compound across the Caco-2 cell line
Caco 2 permeability assay is part of our portfolio of in vitro ADME screening services.
To understand the suitability of a test compound for oral dosing and to predict the absorption of orally-administered drugs, the Caco 2 assay is widely used across the pharmaceutical industry as an in vitro model of the human small intestinal mucosa.
The Caco-2 cell model mimics processes such as transcellular transport, paracellular transport, and some aspects of efflux and active transport. Caco-2 assay is used to predict human intestinal permeability and to investigate drug efflux.
Assessing transport in both directions (apical to basolateral and basolateral to apical) across the cell monolayer yields an efflux ratio.
Monolayers based on Caco-2 cells which express MDR1 and BCRP transporters allow the study of passive permeability, if the test compound functions as substrate or inhibitor of those transporters.
Based on in vitro permeability and solubility data, the Biopharmaceutics Classification System (BCS) is a regulatory mechanism through which one can obtain a waiver of clinical bioequivalence studies, also called a biowaiver.
According to 2000 FDA BCS Guidance , compounds that are classified as Class I (highly soluble and highly permeable) are eligible for BCS biowaivers.
Etudes In Silico/Modelisation
Eurosafe propose ses services in silico pour accélérer votre processus de découverte de médicaments, de criblage à haut débit, de toxicologie, de prévision des propriétés biologiques et de prédiction d'ADME par un modèle pharmacocinétique physiologique (PBPK).
Eurosafe est doté d'installations informatiques et de logiciels de pointe pour la modélisation et l'identification des leads.
Eurosafe propose des services de prédiction de structure tridimensionnelle de protéines par modélisation par homologie, à l’aide des nos méthodes automatisées. La modélisation par homologie utilise la similarité de séquence d’acides aminés avec des structures 3D connues ( par rayons X ou RMN) afin de prédire la structure d’une protéine de conformation inconnue. Les modèles sont qualitativement validés puis optimisés par dynamique moléculaire. Le modèle optimisé pourra être utilisé pour l'amarrage moléculaire, l'ingénierie macromoléculaire et la conception de médicaments.
Le service de modélisation par homologie comprend :
L’alignement des séquences d’acides aminés
La prédiction du modèle 3D
La validation de la structure 3D
L’optimisation de la structure par dynamique moléculaire
Eurosafe propose un service d’amarrage moléculaire pour déterminer l’interaction entre la protéine d'intérêt et le ligand par un algorithme de criblage automatisé à haut débit. Nous rapporterons l’affinité de liaison, la conformation du ligand ainsi qu’une prédiction du site actif. Sur demande, le complexe Protéine-Ligand sera optimisé par une dynamique moléculaire pour un raffinement des interactions.
Le service d’amarrage moléculaire comprend :
La préparation des structures de la protéine et du ligand
La simulation d’amarrage moléculaire
Une prédiction : d’affinité de liaison, de conformation du ligand et du site actif
Optimisation du complexe Protéine-Ligand par dynamique moléculaire
Eurosafe propose un service QSAR incluant la prédiction de relation entre la structure géométrique d’une molécule et son activité biologique. Nous utilisons des méthodes QSAR comme OECD toolbox, VEGA, Toxtree pour prédire le potentiel de sensibilisation cutanée de molécules conformément aux directives de l’OCDE (ENV/JM/MONO(2007)2).
Le service QSAR comprend :
La prédiction de propriétés biologiques
La sensibilisation cutanée des ingrédients
Prédiction du métabolisme cutané et prédiction de la sensibilisation des molécules
L’évaluation de la sécurité des ingrédients
Eurosafe propose un service de modélisation pharmacocinétique physiologique (PBPK) pour prédire la pharmacocinétiques de molécules, en utilisant un logiciel open source PK-SIM développé par Bayer.
Nous proposons un service PBPK pour des expériences pharmacologiques ou toxicologiques in vitro à in vivo, interpolation et extrapolation des connaissances entre :
Effet de la dose et de la durée d'exposition: par exemple d'une exposition continue ou discontinue avec une ou plusieurs expositions.
Effet des voies d’administration (inhalation, ingestion…)
Variations entre espèces et individus étudiés dans la pharmacocinétique des molécules.
L'extrapolation in vitro à in vivo (IVIVE) fait référence à la transposition qualitative ou quantitative de résultats expérimentaux ou d'observations faites in vitro afin de prédire des phénomènes in vivo d'organismes biologiques.
Étude des interactions médicamenteuses (DDI).
Étude du modèle prédictif d’absorption, de distribution, de métabolisme et d’excrétion dans le modèle compartimental ADME.

